Abur

În tehnică, prin abur se înțelege apă în stare de vapori.
În exprimarea curentă, expresiile abur și vapori de apă se folosesc alternativ.
Se spune abur:
- în cazul obținerii sale printr-un proces de fierbere,
- în cazul vaporizării unei părți din apa supraîncălzită (gheizere, scăpări prin neetanșeități),
- la plural, în cazul condensării, fiind vizibili („se văd aburi ridicându-se deasupra mlaștinii”).
Se spune vapori de apă:
- în cazul obținerii lor printr-un proces de evaporare, ei nefiind vizibili,
- la vaporii de apă din atmosferă aflați în stare gazoasă,
- în fizică, chimie (tabele cu proprietăți fizice ale vaporilor de apă).
Aburul este un agent termic larg utilizat în tehnică la producerea lucrului mecanic (ex. în turbine cu abur și în motoarele cu abur), în scopuri tehnologice (ex. în industria chimică, alimentară etc.), pentru încălzit, producerea hidrogenului etc., fiind ușor de produs și putând acumula cantități mari de căldură.[1] Spre deosebire de vaporii de apă din atmosferă, care sunt amestecați cu aer, aburul tehnic nu este amestecat cu alte substanțe, eventualele urme de săruri sau ulei conținute fiind considerate impurități.
Clasificare
[modificare | modificare sursă]Aburul se clasifică în funcție de diferite criterii.[2]
După tip
[modificare | modificare sursă]La o presiune dată, aburul poate fi:
- abur saturat umed, când mai conține lichid;
- abur saturat uscat, când nu mai conține umiditate, dar o cât de mică cedare de căldură îl aduce în stare de abur saturat umed;
- abur supraîncălzit, când temperatura lui e superioară celei de saturație la presiunea respectivă.
După presiune
[modificare | modificare sursă]După valoarea presiunii, se deosebește:
- abur pentru termoficare, cu presiunea de 1,2 - 2,0 bar;
- abur de presiune joasă (până la 15 bar), utilizat în scopuri tehnologice și uneori în instalații de încălzire;
- abur de presiune medie (15 - 80 bar), folosit în turbine de parametri medii;
- abur de presiune înaltă (80 - 221 bar), folosit în turbine de putere mare;
- abur de presiune supracritică (peste 221 bar), folosit în turbine de foarte mare putere.
După proveniență
[modificare | modificare sursă]După proveniență, aburul poate fi:
- abur proaspăt (sau viu), abur adus direct de la generator la utilizator, fără să fi fost utilizat în alt agregat și fără să fi suferit vreo reducere de presiune și temperatură;
- abur derivat (sau prelevat), abur care a fost utilizat parțial într-o mașină și apoi derivat pentru alte scopuri;
- abur uzat, abur evacuat din turbină după utilizarea totală;
- abur laminat, abur căruia i s-a redus presiunea fără producere de lucru mecanic.
Aburul derivat și cel uzat mai este utilizat în scopuri tehnologice sau pentru termoficare. Dacă se pune problema ca o turbină să alimenteze cu abur un proces tehnologic sau termoficarea, aburul este prelevat (la turbinele cu condensație) respectiv evacuat (la turbinele cu contrapresiune) la parametrii necesari procesului, respectiv termoficării.
Proprietăți fizice
[modificare | modificare sursă]
În energetică, proprietățile fizice care prezintă interes sunt:
- masa molară, de care este legat volumul masic, care este un parametru termodinamic;
- Capacitatea termică masică, de care sunt legate valorile entalpiei și entropiei, care definesc starea energetică;
- Conductivitatea termică și viscozitate dinamică, de care depind fenomenele de transfer termic.
Capacitatea termică masică (implicit entalpia și entropia), conductivitatea termică și viscozitatea dinamică depind de presiune și temperatură, după expresii matematice neliniare. Actual aceste proprietăți fac obiectul activității Asociației Internaționale pentru Proprietățile Apei și Aburului (The International Association for the Properties of Water and Steam - IAPWS), care organizează conferințe anuale pentru urmărirea progreselor privind aceste proprietăți și sub egida căreia se redactează formalizări internaționale. Formulele sunt complexe, pentru calculul valorilor fiind necesar un calculator electronic programabil.
În decursul timpului:
- În anul 1904 Richard Mollier trasa primele diagrame având entalpia pe una din axe,[3] bazate pe ecuația de stare a lui Koch:[2]
- În anii '50 Mihail Vukalovici a propus[4] o ecuație de stare cu coeficienți viriali, pe baza cărora s-au calculat valori ale proprietăților aburului utilizate pe plan mondial în deceniile 5 și 6 a secolului al XX-lea.
- Ernst Schmidt a propus succesiv mai multe ecuații de stare empirice,[5] ultima fiind acceptată la Conferința IAPWS din 1966 (IAPWS-66) și care a fost valabilă până în 1968, când IAPWS-68 a adoptat prima formalizare modernă.
Actual se folosesc formalizările:
- IAPWS-95 pentru aplicații științifice (program simplu, foarte precis, dar cu viteză mică), formalizare bazată pe potențialul termodinamic Helmholz. Valorile calculat sunt verificate până la 1000 °C și 10000 bar și se consideră că pot fi extrapolate până la 5000 °C și 100000 bar.
- IAPWS-IF97 pentru aplicații industriale (program cu viteză mare, dar mai puțin precis), bazat pe relații empirice. Valorile calculat sunt bune până la 800 °C și 1000 bar.
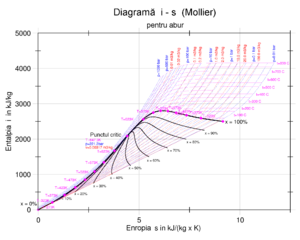
Valorile se găsesc gata calculate în tabele [6], însă în practică este mult mai intuitivă folosirea unor diagrame termodinamice.[6][7] Se folosesc diagrama T-s și diagrama i-s, care sunt larg folosite în aprecierea randamentului termic al ciclului Clausius-Rankine și a randamentului intern al turbinelor cu abur.
Abur umed
[modificare | modificare sursă]La o anumită presiune (ps), apa fierbe la temperatura de saturație (ts). Temperatura de saturație a apei în funcție de presiune se poate calcula cu aproximație cu relația:[8]
- ( °C)
În tehnică se consideră că procesul de fierbere la presiune constantă decurge astfel: absorbind căldură, apa se încălzește până la temperatura de saturație fără să degajeze vapori (aproximație suficient de exactă pentru nevoile practicii), obținându-se apă la saturație. Absorbind căldură în continuare, apa de transformă treptat în abur, fără ca temperatura sa să varieze. În momentul în care toată apa s-a vaporizat, ea s-a transformat în abur saturat (uscat). Introducând căldură în continuare, temperatura aburului crește, el devenind abur supraîncălzit.

În perioada trecerii de la apă la saturație la abur saturat, amestecul de abur saturat și apă la saturație se numește abur (saturat) umed. Proporția de abur saturat în amestec este titlul aburului:
unde mapa este masa apei la saturație, iar mabur este masa aburului saturat.
Titlul aburului ia valori între 0 (apă la saturație) și 1 (abur saturat). Pentru diferite presiuni, în diagrama T-s (v. fig. alăturată) starea de apă la saturație este pe curba de x = 0, iar starea de abur supraîncălzit este pe curba de x = 1. La presiunea normală (de 101325 Pa = 1,013 bar) căldura latentă de vaporizare (căldura necesară fierberii) este de 2257 kJ/kg. La presiuni mai mari, această căldură scade, curbele x = 0 și x = 1 se apropie și se întâlnesc la presiunea critică de 221,2 bar în punctul critic, a cărui temperatură este de 374 °C. Peste această presiune, este domeniul supracritic, în care vaporizarea apei se face fără o transformare de fază vizibilă, prin umflare continuă.[9]
Domeniul din diagrama T-s de sub curbele x = 0 și x = 1 este domeniul aburului umed.
Abur supraîncălzit
[modificare | modificare sursă]Este folosit în special în termoenergetică, unde parametrii aburului viu sunt următorii:[10]
| Simbol | A | B † | C | D | E | F ‡ |
| Presiune (bar) | 35 | 63 | 90 | 130 | 165 | 180 |
| Temperatură °C | 435 | 510 | 535 | 535 / 565 | 535 / 565 | 535 / 565 |
† Nu se mai folosește.
‡ Pentru cicluri cu resupraîncălzire intermediară.
Termoliza aburului
[modificare | modificare sursă]Aburul este disociat direct prin termoliză în oxigen și hidrogen începând de la temperatura de 1700 °C.[11] La temperatura de 2300 °C disociază circa 3 % din masa aburului, iar la 3000 °C disociază circa 50 %. Aceste temperaturi sunt prea mari pentru aplicațiile practice.[12] Chiar dacă cu ajutorul unor reacții chimice auxiliare temperatura de disociere poate fi coborâtă,[11] pentru a realiza disocierea nu este suficientă doar temperatura. Disocierea este o reacție endotermă, absorbind teoretic o energie de 121 MJ/kg de hidrogen obținut, exact atât cât se degajă prin arderea acestui hidrogen. Ca urmare, disocierea aburului nu este o promisiune pentru folosirea apei drept combustibil.[13] În plus, în aplicațiile practice intervin și randamentele energetice tehnice ale transformărilor abur -> hidrogen + oxigen -> abur (apă), fiecare de circa 60 %, care duc la pierderea a circa 2/3 din energia introdusă în proces, reducând și mai mult perspectiva utilizării hidrogenului din apă drept combustibil.[13] Prin conținutul său masic de 11,1 % de hidrogen aburul (apa) poate fi o sursă de hidrogen, dar în industrie hidrogenul obținut din gaz natural este de 3–4 ori mai ieftin decât cel obținut din abur (apă).[12]
Utilizări
[modificare | modificare sursă]În tehnică
[modificare | modificare sursă]Aburul industrial este produs în generatoare de abur și este folosit:
- ca agent de lucru în turbine cu abur și motoare cu abur (locomotive cu abur) - de remarcat că marile termocentrale pot avea producții de abur de mii de tone pe oră;
- ca agent termic la extracția țițeiului și la rafinarea lui, precum și în reacțiile de cracare pentru obținerea benzinei;
- ca agent termic în industria ușoară, la fierberi în industria alimentară, vopsitorie și călcătorie în industria textilă, la curbarea și uscarea lemnului în industria mobilei;
- la desalinizarea apei de mare;
- ca materie primă la producerea gazului de apă;
- ca agent termic la încălzirea cu abur, respectiv în termoficare;
- ca fluid de antrenare în ejectoarele de abur;
- ca materie primă pentru obținerea apei distilate;
- ca agent de lucru la obținerea vidului prin condensare în condensatoare;
- la producerea hidrogenului prin reformarea catalitică a metanului cu abur
În medicină
[modificare | modificare sursă]- la aparate de sterilizat;
- la inhalații.
Pentru uz casnic
[modificare | modificare sursă]- la prepararea alimentelor;
- la călcat cu fierul de călcat cu aburi;
- la curățarea cu aburi;
- în saune.
Note
[modificare | modificare sursă]- ^ Academia Republicii Populare Române, Dicționar Enciclopedic Român, Editura Politică, București, 1962-1964
- ^ a b Răduleț, R. și colab. Lexiconul Tehnic Român, Editura Tehnică, București, 1957-1966.
- ^ Mollier, R. Neue Diagramme zur Technischen Wärmelehre, Springer-Verlag, Berlin, 1904
- ^ Vukalovici, M. P. Tablițî termodinamiceskih svoistv vodu i vodianogo para, Ed Moskva, Leningrad, 1963
- ^ Schmidt, E. Technische Termodynamik, Springer Verlag, Berlin, 1975
- ^ a b Properties of Water and Steam in SI-Units. Thermodynamische Eigenschaften von Wasser und Wasserdampf, 0 - 800 °C, 0 - 1000 bar, Springer Verlag, Berlin, 1981. ISBN 3-540-09601-9, ISBN 0-387-09601-9
- ^ Mollier h,s-Diagram for Water and Steam, Springer Verlag, Berlin 1998. ISBN 3-540-64375-3
- ^ Theil, H. Termotehnică și mașini termice, Litografia Institulului Politehnic Timișoara, 1972.
- ^ Vlădea, I. Tratat de termodinamică tehnică și transmiterea căldurii, Editura Didactică și Pedagogică, București, 1974
- ^ Creța, G. Turbine cu abur și cu gaze, Editura Tehnică, 1996, ISBN 973-31-0965-7
- ^ a b Sergiu Varan, Obținerea hidrogenului Arhivat în , la Wayback Machine., tabelulperiodic.ro, 21 iulie 2015, accesat 2018-08-24
- ^ a b Oprișa-Stănescu, Autovehicule…, p. 110
- ^ a b Oprișa-Stănescu, Autovehicule…, p. 109
Bibliografie
[modificare | modificare sursă]- Paul-Dan Oprișa-Stănescu, Autovehicule electrice hibride și cu pile de combustie, Timișoara: Ed. „Politehnica”, 2015, ISBN: 978-606-35-0011-4
Vezi și
[modificare | modificare sursă]- Lista paginilor care conțin în titlu termenul „Abur”
- Aburire
- Centrală termică
- Termoficare
- Cazan
- Turbină cu abur
- Motor cu abur
- Locomotivă cu abur
- Umiditate
- Vapori
Legături externe
[modificare | modificare sursă]- IAPWS
- Formalizarea IAPWS-95 (PDF) Arhivat în , la Wayback Machine.
- Formalizarea IAPWS-IF97 (PDF) Arhivat în , la Wayback Machine.
- Cod program după formalizarea IAPWS-IF97
- Tabele cu proprietățile termodinamice ale apei și aburului, Institutul Național pentru Standarde și Tehnologii (National Institute of Standards and Technology, NIST)
- Ce e aburul? (articol despre proprietățile apei și aburului, en)
- Calculator online a proprietăților termodinamice ale aburului (Spirax Sarco, en)
- Electroliza aburului
Acest articol conține text din Dicționarul enciclopedic român (1962-1966), aflat acum în domeniul public.

![{\displaystyle v={\frac {RT}{p}}-{\frac {A}{\left({\frac {T}{100}}\right)^{2,82}}}-p^{2}\left[{\frac {B}{\left({\frac {T}{100}}\right)^{14}}}+{\frac {C}{\left({\frac {T}{100}}\right)^{31,6}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c21616bab8fe0cb3cc8c256b9e560310a8e42494)
![{\displaystyle t_{s}=100\,{\sqrt[{4}]{p_{s}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/397ec8dd0a6be6191cdbc52788e129bb80135b56)

