Colorație Ziehl-Neelsen

Colorația Ziehl–Neelsen, de asemenea cunoscută ca și colorație acido-alcoolo- rezistentă, a fost descrisă pentru prima dată de către doi medici germani: bacteriologul Franz Ziehl(d) (1859-1926) și anatomopatologul Friedrich Neelsen(d) (1854-1898). Este o colorație specială pentru bacterii folosită pentru a identifica organisme acido-alcoolo-rezistente, în special micobacterii. Mycobacterium tuberculosis este cea mai importantă din acest grup deoarece este responsabilă pentru tuberculoză (TB). Alte specii de Mycobacterium implicate în bolile umane sunt Mycobacterium leprae, Mycobacterium kansasii(d), Mycobacterium marinum(d), Mycobacterium bovis(d), Mycobacterium africanum(d) și membrii complexului Mycobacterium avium-intracellulare infection(d). Complexul Mycobacterium avium-intracellulare infection(d) cuprinde două specii: Mycobacterium avium și Mycobacterium intracellulare; deoarece aceste specii sunt greu de diferențiat ne referim la ele colectiv ca Mycobacteriu avium-intracellulare. Organismele acido-alcoolo-rezistente, cum ar fi Mycobacterium conțin cantități mari de substanțe lipidice în pereții celulari numiți acizi micolici. Acești acizi rezistă la colorare prin metode obișnuite, cum ar fi colorația Gram.[1] Această colorație poate fi, de asemenea, folosită pentru a colora câteva alte bacterii, cum ar fi Nocardia(d). Reactivii utilizați sunt fucsina funicată(carbol fucsina) Ziehl–Neelsen, acid, alcool și albastru de metilen. Bacilii acido-alcoolo-rezistenți vor fi roșu aprins după colorare.
O variantă a acestei metode de colorare este folosită în micologie pentru a diferenția depunerile acido-alcoolo-rezistente din cuticula hifelor ale anumitor specii de ciuperci din genul Russula.[2][3] De asemenea, este utilă în identificarea unor protozoare, și anume Cryptosporidium(d) și Isospora(d). Colorația Ziehl–Neelsen poate împiedica, de asemenea, diagnosticul în caz de paragonimiază(d) pentru că ouăle într-un ovul și paraziții din eșantioanele de spută (OnP) pot fi dizolvate prin colorație, și este adesea folosită în acest cadru clinic pentru că semnele și simptomele de paragonimiază se aseamănă foarte mult cu cele din TBC. Există și părerea conform căreia colorarția Ziehl-Nielsen nu afectează diagnosticarea paragonimiazei. [4][5]
Metoda
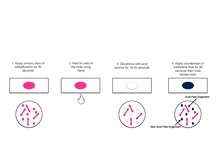
[modificare | modificare sursă]Metoda de colorare acido-alcoolo-rezistentă tipică implică depunerea celulelor din suspensie pe o lamă, apoi uscarea lichidului la aer și fixarea la căldură a celulelor. Lama este acoperită cu fucsina funicată, care este apoi încălzită până la începerea evaporării colorantului și se înlătură fucsina prin spălare cu apă de robinet. Lama este apoi acoperită cu o soluție de acid clorhidric 1% în alcool izopropilic (sau metanol) pentru a îndepărta fucsina funicată, astfel îndepărtând colorantul de pe celulele care sunt neprotejate de un strat ceros lipidic. Ulterior celulele sunt colorate cu albastru de metilen și văzute la microscopul cu imersie.
Studiile au arătat că o colorație acido-alcoolo- rezistentă fără o însămânțare are o valoare predictivă negativă slabă. Însămânțarea ar trebui efectuată în paralel cu colorarea acido-alcoolo-rezistentă; aceasta are o valoare predictivă negativă mai mare.
Explicarea mecanismului
[modificare | modificare sursă]Inițial, fucsina funicată colorază fiecare celulă. Atunci când acestea sunt decolorate cu acid-alcool, numai bacteriile non-acido-alcoolo-rezistente ajung decolorate deoarece nu au un strat cerat lipidic gros, ca bacteriile acido-alcoolo-rezistente. Atunci când este aplicată contra colorația, bacteriile non-acido-alcoolo- rezistente se colorează și devin albastre când sunt privite la microscop. Bacteriile acido-alcoolo-rezistente păstrează fucsina funicată astfel încât acestea apar roșii.
Modificări
[modificare | modificare sursă]- 1% acid sulfuric alcool pentru actinomicete(d), Nocardia(d).
- 0.5-1% acid sulfuric alcool pentru oochisturi de Isospora(d), Cyclospora(d).
- 0.25–0.5% acid sulfuric alcool pentru endosporii bacterieni.
- colorant diferențial pentru Brucella – acid acetic glacial folosit, fără căldură aplicată, colorant secundar este e albastru de metilen Loeffler.
- Kinyoun stain(d) modificat (sau Ziehl–Neelsen tehnic rece) este, de asemenea, disponibil.
- Un protocol în care un detergent înlocuiește fenolul extrem de toxic în soluția de colorare cu fucsină.[6]
Vezi și
[modificare | modificare sursă]Referințe
[modificare | modificare sursă]- ^ Morello, Josephine A., Paul A. Granato, Marion E. Wilson, and Verna Morton.
- ^ Romagnesi, H. (). Les Russules d'Europe et d'Afrique du Nord. Bordas. ISBN 0-934454-87-6.
- ^ Largent, D; D Johnson; R Watling (). How to identify fungi to genus III: microscopic features. Mad River Press. ISBN 0-916422-09-7.
- ^ „No Paragonimus in high-risk groups in Côte d'Ivoire, but considerable prevalence of helminths and intestinal protozoon infections”.
- ^ „Ziehl-Neelsen staining technique can diagnose paragonimiasis”.
- ^ Ellis, RC; LA Zabrowarny. (). „Safer staining method for acid fast bacilli” (PDF). Journal of Clinical Pathology. 46: 559–560. doi:10.1136/jcp.46.6.559. PMC 501296
 . PMID 7687254. Mai multe valori specificate pentru
. PMID 7687254. Mai multe valori specificate pentru |pmc=și|PMC=(ajutor); Mai multe valori specificate pentru|pmid=și|PMID=(ajutor); Mai multe valori specificate pentru|DOI=și|doi=(ajutor)
Bibliografie
[modificare | modificare sursă]- "Microbiology with Diseases by Body System", Robert W. Bauman, 2009, Pearson Education, Inc.
- Morello, Josephine A., Paul A. Granato, Marion E. Wilson, and Verna Morton. Laboratory Manual and Workbook in Microbiology: Applications to Patient Car. 10th ed. Boston: McGraw-Hill Higher Education, 2006. Print.
Exemple online de protocoale
[modificare | modificare sursă]- Protocol pentru colorația Ziehl–Neelsen Arhivat în , la Wayback Machine. (format PDF).
Legături externe
[modificare | modificare sursă] Materiale media legate de Colorația Ziehl-Neelsen la Wikimedia Commons
Materiale media legate de Colorația Ziehl-Neelsen la Wikimedia Commons
