Acid fluoroantimonic
| Acid Fluoroantimonic | |
 Molecula 3D | |
 | |
| Denumiri | |
|---|---|
| Identificare | |
| Număr CAS | 16950-06-4 |
| PubChem CID | 6337100 |
| Informații generale | |
| Formulă chimică | HSbF₆ |
| Aspect | lichid gros, ușor colorat |
| Masă molară | 236,808 g/mol |
| Proprietăți | |
| Densitate | 3 g/cm3 |
| Starea de agregare | lichid |
| Punct de topire | Nedefinit, datorită naturii sale extrem de reactive |
| Punct de fierbere | Se descompune rapid în prezența H₂O |
| Solubilitate | Reacție exotermă cu apa |
| Duritate (Scara Mohs) | 0 |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul fluoroantimonic HSbF
6 este o mixtură a doi compuși: acid fluorhidric (HF) și pentafluorură de stibiu (SbF
5) în diferite proporții.[1] Raportul de 1:1 alcătuiește unul dintre cei mai puternici superacizi, superacid ce protonează hidrocarburile la stadiul de carbo-cation și hidrogen (H
2).
Generalități
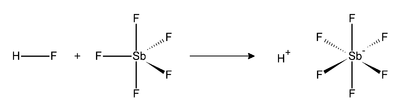
[modificare | modificare sursă]Reacția dintre HF și SbF
5 este exotermă.
HF eliberează un proton (H+), iar baza sa conjugată (F−) intră în structura anionului SbF−
6, anion considerat compus noncoordinativ datorită faptului că este un foarte slab agent nucleofilic și de asemenea o bază foarte slabă. Acest anion cu structură octaedrică are protonul complet liber fapt ce determină aciditatea sa de 2×1019 ori mai puternică față de acidul sulfuric.
Structură
[modificare | modificare sursă]2 compuși au fost izolați din mixtura de HF-SbF5. amîndoi cercetați prin metoda cristalografiei cu raze X: [H2F+][Sb2F11−] și [H3F2+][Sb2F11−].În ambii compuși anionul este Sb2F11−.[2]
Comparație cu alți acizi
[modificare | modificare sursă]Următoarele valori au la bază scara acidității Hammett:
- Acid fluoroantimonic (1990) (H0 Value = −31.3)
- Acid Magic (1974) (H0 Value = −19.2)
- Carboran (1969) (H0 Value = −18.0)
- Acid fluorosulfuric (1944) (H0 Value = −15.1)
- Acid triflic (1940) (H0 Value = −14.9)
Aplicații
[modificare | modificare sursă]Acest acid protonează aproape orice compus organic.În 1967, Bickel and Hogeveen arată că HF-SbF5 îndepărtează H2 din izobutan și metanul din neopentan:[3][4]
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
Siguranță
[modificare | modificare sursă]HF-SbF5 este rapid descompus de către apă reacție ce este explozivă.Reacționează cu toți solvenții cunoscuți.
Referințe
[modificare | modificare sursă]- ^ Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X. “Hydrogen Fluoride–Antimony(V) Fluoride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ^ Mootz, D.; Bartmann, K. (). „The Fluoronium Ions H2F+ and H3F2+: Characterization by Crystal Structure Analysis”. Angewandte Chemie, International Edition in English. 27: 391–392. doi:10.1002/anie.198803911.
- ^ Bickel, A. F.; Gaasbeek, C. J.; Hogeveen, H.; Oelderik, J. M.; Platteeuw, J. C. (). „Chemistry and spectroscopy in strongly acidic solutions: reversible reaction between aliphatic carbonium ions and hydrogen”. Chemical Communications. 1967: 634–5. doi:10.1039/C19670000634.
- ^ Hogeveen, H.; Bickel, A. F. (). „Chemistry and spectroscopy in strongly acidic solutions: electrophilic substitution at alkane-carbon by protons”. Chemical Communications. 1967: 635–6. doi:10.1039/C19670000635.
| |||||||||||||