Cloroform
| Cloroform | |
 | |
| Nume IUPAC | Triclorometan |
|---|---|
| Alte denumiri | Cloroform Clorură de metin Clorură de metilidin |
| Identificare | |
| Număr CAS | 67-66-3 |
| ChEMBL | CHEMBL44618 |
| PubChem CID | 6212 |
| Informații generale | |
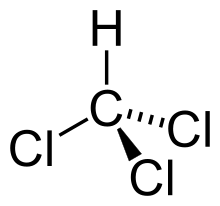
| Formulă chimică | CHCl3 |
| Aspect | lichid incolor |
| Masă molară | 119,38 g/mol |
| Proprietăți | |
| Densitate | 1,48 g/cm3 (20 °C) |
| Starea de agregare | lichidă |
| Punct de topire | −63 °C |
| Punct de fierbere | 61 °C |
| Solubilitate | bună în etanol, eter, benzol, aproape insolubil în apă |
| Presiune de vapori | 160 mm Hg[2] |
| Fraze R | R22, R38, R40, R48/20/22 |
| Fraze S | (S2), S36/37 |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Cloroformul sau triclorometanul este o hidrocarbură clorurată cu formula chimică CHCl3. A fost descoperit în 1831 de Justus von Liebig, Samuel Guthrie și Eugène Soubeiran.
Proprietăți
[modificare | modificare sursă]Triclorometanul este un lichid incolor, neinflamabil cu un miros dulceag. Are o densitate mai mare decât apa, fiind solubil numai în solvenți organici. Vaporii de cloroform determină prin inhalare pierderea cunoștinței și reducerea sensibilității la durere. Din cauza efectului toxic asupra inimii, ficatului și altor organe interne, în prezent nu mai este folosit ca narcotic. Se presupune că ar avea și un efect cancerigen. Cloroformul în prezența oxigenului la lumină se descompune formându-se fosgen, clor și acid hipocloros (HClO). Cloroformul existent în comerț este un amestec cu 0,5–1,0 % etanol ca stabilizator.
Obținere
[modificare | modificare sursă]Pe scară industrială cloroformul se obține prin încălzirea la 400–500 °C a clorului cu metan sau clorură de metan, având loc o reacție de substituție:
In final rezultă un amestec de cloruri de metan care se separă printr-o distilare fracționată.
Utilizare
[modificare | modificare sursă]Cloroformul este folosit mai ales ca diluant și la producerea clorofluorocarburi care este răspunzător de formarea golurilor de ozon din straturile superioare ale atmosferei. Cloroformul deuterizat, (CDCl3), fiind numit cloroform-deuteriu este utilizat în spectroscopia nucleară (NMR).
Bioremedirea cloroformului
[modificare | modificare sursă]Unele bacterii anaerobe folosesc cloroformul pentru respirație, în procesul numit respirație organohalidă(en)[traduceți], convertindu-l în diclormetan.[3][4]
Note
[modificare | modificare sursă]- ^ „cloroform”, CHLOROFORM (în engleză), PubChem, accesat în
- ^ http://www.cdc.gov/niosh/npg/npgd0127.html Lipsește sau este vid:
|title=(ajutor) - ^ Shuiquan Tang, Elizabeth A. Edwards (). „Identification of Dehalobacter reductive dehalogenases that catalyse dechlorination of chloroform, 1,1,1-trichloroethane and 1,1-dichloroethane”. Philos Trans R Soc Lond B Biol Sci. 368. doi:10.1098/rstb.2012.0318.
- ^ Jugder, Bat-Erdene; Ertan, Haluk; Wong, Yie Kuan; Braidy, Nady; Manefield, Michael; Marquis, Christopher P.; Lee, Matthew (). „Genomic, transcriptomic and proteomic analyses of Dehalobacter UNSWDHB in response to chloroform”. Environmental Microbiology Reports (în engleză). 8 (5): 814–824. doi:10.1111/1758-2229.12444. ISSN 1758-2229.
Legături externe
[modificare | modificare sursă]- Chloroform "The Molecular Lifesaver" An article at Oxford University providing facts about chloroform.
- Concise International Chemical Assessment Document 58
- IARC Summaries & Evaluations: Vol. 1 (1972), Vol. 20 (1979), Suppl. 7 (1987), Vol. 73 (1999)
- NIST Standard Reference Database
- Story on Chloroform from BBC's The Material World (28 July 2005)
- Sudden Sniffer's Death Syndrome Arhivat în , la Wayback Machine. article at Carolinas Poison Center
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of chloroform
- ChemSub Online: Chloroform – Methane, trichloro-





