Presiune de vapori
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |

Presiunea de vapori este o mărime fizică ce face referire la presiunea la care coexistă faza gazoasă și faza lichidă sau solidă a unei substanțe, la echilibru termodinamic și la o temperatură dată.[1][2] Presiunea de vapori depinde de natura substanței și de temperatură.[3]
Presiunea de vapori în sisteme închise
[modificare | modificare sursă]Substanțele pot prezenta patru stări de agregare: solidă, lichidă, gazoasă și plasmă. În stare gazoasă, substanțele pot exista sub formă de vapori sau de gaz.
Gazul este forma sub care se prezintă faza gazoasă a unei substanțe la temperaturi peste temperatura critică.
Vaporii sunt forma sub care se prezintă faza gazoasă a unei substanțe la temperaturi sub temperatura critică.
La temperatură constantă, într-un sistem închis parțial umplut cu lichid se realizează în mod spontan o stare de echilibru între faza lichidă și cea gazoasă. În starea de echilibru, cantitatea ce se vaporizează este egală cu cantitatea ce se lichefiază. Vaporii aflați în echilibru de fază cu lichidul se numesc vapori saturați, presiunea de vapori atingând în acest caz valoarea sa maximă , numită presiune de saturație a vaporilor.
La temperatură constantă, presiunea de saturație a vaporilor este constantă și nu depinde de volumul recipientului în care se află substanța. Dacă volumul se mărește, o parte din lichid se evaporă, și presiunea de vapori nu se modifică, atâta timp cât mai există lichid. Când lichidul trece în totalitate în fază gazoasă, atunci nu se mai măsoară presiunea de vapori, ci presiunea gazului. (Dacă volumul continuă să se mărească, gazul suferă o transformare izotermă, iar presiunea gazului scade sub valoarea presiunii de saturație). Dacă volumul se micșorează, o parte din vapori se condensează, și presiunea de vapori nu se modifică. Procesul de condensare se produce doar sub o anumită temperatură, numită temperatură critică.
Dacă în sistem se găsesc mai multe substanțe, presiunea măsurată în faza gazoasă este suma presiunilor parțiale ale substanțelor din sistem (legea presiunilor parțiale a lui Dalton, pentru gazele ideale):
Presiunea vaporilor de apă
[modificare | modificare sursă]| Acest articol are nevoie de atenția unui expert în domeniu. Recrutați unul sau, dacă sunteți în măsură, ajutați chiar dumneavoastră la îmbunătățirea articolului! |
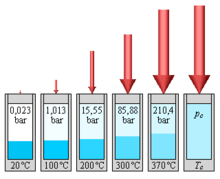
Existența echilibrului termodinamic dintre apă și vaporii de apă face presiunea o funcție a temperaturii:
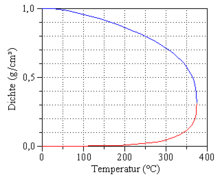
Presiunea aceasta dependentă de temperatură și de specificul substanței este numit presiunea vaporilor, putând fi observat în graficul alăturat curba presiunii, care se termină la punctul critic.
La ridicarea temperaturii crește presiunea și densitatea vaporilor în aceeași măsură scade densitatea lichidului. Proprietatea apei și vaporilor prin creșterea continuă a temperaturii vor deveni tot mai asemănătoare, până la punctul critic când va deveni identică, când va exista o singură fază (vezi figura alăturată). La apropierea de punctul critic dispare căldura de evaporare apărând fluctuații a densității, care poate fi recunoscut prin o opalescență critică.
Vezi și
[modificare | modificare sursă]- Presiunea de saturație a vaporilor de apă
- Abur
- Azeotrop
- Ceață
- Potențial chimic
- Sublimare
- Umiditate
- Proprietate coligativă
- Activitate termodinamică
- Legea lui Raoult
- Volatilitate
Note
[modificare | modificare sursă]- ^ Růžička, K.; Fulem, M.; Růžička, V. „Vapor Pressure of Organic Compounds. Measurement and Correlation” (PDF). Arhivat din original (PDF) la . Accesat în .
- ^ „Vapor Pressure”, Purdue University - Department of Chemistry, accesat în
- ^ Linus Pauling (1972). Chimie generală. Editura Științifică, București. pag. 51.
Bibliografie
[modificare | modificare sursă]- D Geană Termodinamică chimică. Teoria echilibrului intre faze și chimic Editura Politehnica Press, 2003
- Fr. A. Gothard Echilibre lichid-vapori I - Baze teoretice și de calcul, Editura Academiei RSR, 1975



