Experimentul Franck-Hertz

Experimentul Franck-Hertz a fost prima măsurătoare electrică care a demonstrat în mod clar natura cuantică a atomilor și, astfel, „a transformat felul cum înțelegem noi lumea”.[1] A fost prezentat la Societății Fizice Germane într-un articol de James Franck și Gustav Hertz.[2][3] Franck și Hertz proiectaseră un tub vidat pentru studierea electronilor excitați care se deplasau prin vapori rarefiați de atomi de mercur. Ei au descoperit că, atunci când un electron se ciocnește cu un atom de mercur, el poate pierde doar o anume cantitate (4,9 electron-volți) din energia sa cinetică înainte de se îndepărta.[4] Această pierdere de energie corespunde decelerării electronului de la o viteză de aproximativ 1,3 milioane de metri pe secundă până la zero.[5] Un electron mai rapid nu decelerează complet după o coliziune, ci doar pierde exact aceeași cantitate de energie cinetică. Electronii mai lenți doar ricoșează din atomii de mercur fără a pierde semnificativ din viteza sau din energia lor cinetică.
Aceste rezultate experimentale s-au dovedit a fi în concordanță cu modelul Bohr al atomului propus de Niels Bohr în anul precedent. Modelul Bohr a fost un precursor al mecanicii cuantice și al modelului cu învelișuri electronice al atomului. Trăsătura sa-cheie a fost aceea că un electron din interiorul unui atom ocupă unul dintre „nivelele cuantice de energie” ale atomului. Înainte de coliziune, un electron din interiorul atomului de mercur ocupă cel mai scăzut nivel de energie disponibil. După coliziune, electronul din interior ocupă un nivel de energie mai ridicat cu 4,9 electron-volți (eV). Aceasta înseamnă că electronul este legat mai slab de atomul de mercur. Nu există niveluri sau posibilități intermediare în modelul cuantic al lui Bohr. Această caracteristică era „revoluționară”, deoarece era incompatibilă cu așteptarea ca un electron să poată fi legat de nucleul unui atom cu orice cantitate de energie.[4][6]
Într-o a doua lucrare prezentată în mai 1914, Franck și Hertz au scris despre emisia de lumină a atomilor de mercur care absorbeau energia din coliziuni.[7] Ei au arătat că lungimea de undă a acestei lumini ultraviolete corespundea exact energiei de 4,9 eV pe care electronul excitat l-a pierdut. Relația dintre energie și lungimea de undă a fost prezisă și de Bohr.[4] După o prezentare a acestor rezultate de către Franck câțiva ani mai târziu, se spune că Albert Einstein ar fi remarcat: „Este atât de minunat că îți vine să plângi”. [1]
La , Franck și Hertz au primit Premiul Nobel pentru Fizică pe anul 1925 „pentru descoperirea legilor care guvernează impactul unui electron cu un atom”.[8]
Experimentul
[modificare | modificare sursă]
În cadrul primelor experimente ale lui Franck și Hertz au folosit un tub vidat încălzit care conține o picătură de mercur; ei au consemnat o temperatură a tubului de 115 °C, la care presiunea vaporilor de mercur este de aproximativ 100 pascali (și mult sub presiunea atmosferică).[2][9] Un tub Franck-Hertz contemporan este prezentat în fotografie. Acesta este echipat cu trei electrozi: un catod incandescent care emite electroni; o grilă metalică; și un anod. Potențialul grilei este pozitiv în raport cu catodul, astfel încât electronii emiși de catodul incandescent sunt atrași de aceasta. Curentul electric măsurat în experiment se datorează electronilor care trec prin grilă și ajung la anod. Potențialul electric al anodului este ușor negativ față de grilă, astfel încât electronii care ajung la anod au cel puțin o cantitate corespunzătoare de energie cinetică după trecerea prin grilă. [10]

Graficele publicate de Franck și Hertz (vezi figura) arată dependența curentului electric care iese din anod de tensiunea electrică dintre grilă și catod.
- La diferențe de potențial mici — până la 4,9 volți — curentul prin tub crește constant cu creșterea diferenței de potențial. Acest comportament este tipic pentru tuburile de vid adevărate care nu conțin vapori de mercur; tensiunile mai mari conduc la un „curent limitat de sarcină spațială(d)”.
- La 4,9 volți curentul scade brusc, aproape până la zero.
- Curentul crește apoi în mod constant din nou, pe măsură ce tensiunea crește și mai mult până se ajunge la 9,8 volți (exact 4,9 + 4,9 volți).
- La 9,8 volți se observă o scădere bruscă similară.
- Deși nu este evident în măsurătorile originale ale figurii, această serie de scăderi ale curentului, cu creșteri în incremente de aproximativ 4,9 volți, continuă până la potențiale de cel puțin 70 de volți. [11]
Franck și Hertz au remarcat în prima lor lucrare că energia caracteristică de 4,9 eV a experimentului lor corespunde bine cu una dintre lungimile de undă ale luminii emise de atomii de mercur în descărcările în gaz(d). Ei folosiseră o relație cuantică între energia de excitație și lungimea de undă corespunzătoare a luminii, pe care au atribuit-o în mare măsură lui Johannes Stark și lui Arnold Sommerfeld; ea prezice că 4,9 eV corespunde luminii cu o lungime de undă de 254 nm.[2] Aceeași relație a fost încorporată și în teoria fotonică a efectului fotoelectric elaborată de Einstein în 1905.[12] Într-o a doua lucrare, Franck și Hertz au consemnat emisia optică din tuburile lor,care emiteau lumină cu o singură lungime de undă proeminentă de 254 nm.[7] Figura din dreapta ilustrează spectrul unui tub Franck-Hertz; aproape toată lumina emisă are o singură lungime de undă. Pentru referință, figura prezintă și spectrul luminii unei descărcări în gaz de mercur, care emite lumină la câteva lungimi de undă în afară de 254 nm. Cifra se bazează pe spectrele originare publicate de Franck și Hertz în 1914. Faptul că tubul Franck-Hertz emitea doar o singură lungime de undă, care corespunde aproape exact perioadei de tensiune măsurată, era foarte important.[10]
Modelarea coliziunilor electronilor cu atomi
[modificare | modificare sursă]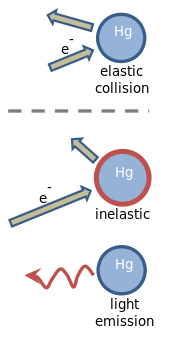
Franck și Hertz și-au explicat experimentul în termeni de coliziuni elastice(d) și inelastice(d) între electroni și atomii de mercur.[2][3] Electronii care se mișcă încet se ciocnesc elastic cu atomii de mercur. Aceasta înseamnă că direcția în care se deplasează electronul este modificată de coliziune, dar viteza lui rămâne neschimbată. O coliziune elastică este ilustrată în figură, unde lungimea săgeții indică viteza electronului. Atomul de mercur nu este afectat de ciocnire, mai ales pentru că este de aproximativ patru sute de mii de ori mai masiv decât un electron.[13][14]
Când viteza electronului depășește aproximativ 1,3 milioane de metri pe secundă,[5] coliziunile cu atomii de mercur devenin inelastice. Această viteză corespunde unei energii cinetice de 4,9 eV, care este depozitată în atomul de mercur. Așa cum se arată în figură, viteza electronului este redusă, iar atomul de mercur devine „excitat”. La scurt timp, energia de 4,9 eV depozitată în atomul de mercur este eliberată ca lumină ultravioletă, care are o lungime de undă de exact 254 nm. În urma emisiei de lumină, atomul de mercur revine la starea inițială, neexcitată.[13][14]
Dacă electronii emiși de catod zboară liber până când ajung la grilă, aceștia dobândesc o energie cinetică proporțională cu tensiunea aplicată rețelei. 1 eV de energie cinetică corespunde unei diferențe de potențial de 1 volt între grilă și catod.[15] Coliziunile elastice cu atomii de mercur cresc timpul necesar unui electron pentru a ajunge la grilă, dar energia cinetică medie a electronilor care sosesc acolo nu este mult afectată.[14]
Când tensiunea rețelei atinge 4,9 V, coliziunile electronilor în apropierea grilei devin inelastice, iar electronii sunt foarte mult încetiniți. Energia cinetică a unui electron tipic care ajunge la grilă este redusă atât de mult încât nu se mai poate deplasa în continuare pentru a ajunge la anod, al cărui potențial este reglat în așa fel încât să respingă ușor electronii. Curentul electronilor care ajung la anod scade, după cum se vede în grafic. Creșterea suplimentară a potențialului grilei restabilește suficientă energie pentru ca electronii care au suferit coliziuni inelastice să mai poată ajunge din nou la anod. Curentul crește din nou pe măsură ce potențialul grilei se ridică peste 4,9 V. La 9,8 V, situația se schimbă din nou. Electronii care au parcurs aproximativ jumătatea distanței dintre catod și grilă au acumulat deja suficientă energie pentru a suferi o primă coliziune inelastică. Pe măsură ce aceștia continuă mai încet spre grilă de la jumătatea distanței încolo, energia cinetică se acumulează din nou, dar pe măsură ce ajung la grilă, ei pot suferi o a doua coliziune inelastică. Încă o dată, curentul la anodul scade. La intervale de 4,9 volți, acest proces se va repeta de fiecare dată când electronii vor suferi o coliziune inelastică suplimentară.[13][14]
Teoria cuantică veche
[modificare | modificare sursă]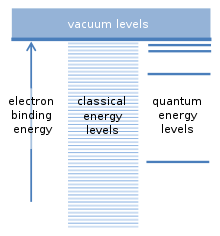
Franck și Hertz nu știau, atunci când și-au publicat experimentele în 1914,[16] că în 1913, Niels Bohr publicase un model al atomilor care reușea foarte bine să țină cont de proprietățile optice ale hidrogenului atomic. Acestea se observau adesea în descărcările în gaz, care emiteau lumină la o serie de anumite lungimi de undă. Sursele obișnuite de lumină, cum ar fi becurile incandescente, emiteau lumină la toate lungimile de undă. Bohr a calculat lungimile de undă emise de hidrogen cu mare precizie.[17]
Ipoteza fundamentală a modelului Bohr se referă la posibilele energii de legătură a unui electron cu nucleul unui atom. Atomul poate fi ionizat dacă o coliziune cu o altă particulă furnizează cel puțin această energie de legătură. Aceasta eliberează electronul de atom și lasă în urmă un ion încărcat pozitiv. Există o analogie cu sateliții care orbitează Pământul. Fiecare satelit are o orbită proprie și practic este posibilă orice distanță orbitală și orice energie legată de satelit. Deoarece un electron este atras de sarcina pozitivă a nucleului atomic printr-o forță similară, așa-numitele calcule „clasice” sugerează că ar trebui să fie posibilă orice energie de legătură și pentru electroni. Cu toate acestea, Bohr a presupus că există doar o serie anume de energii de legătură, care corespund „nivelurilor cuantice de energie” pentru electron. Un electron se găsește în mod normal la cel mai scăzut nivel de energie, cu cea mai mare energie de legătură. Nivelurile suplimentare se situează mai sus, cu energii de legătură mai mici. Energiile de legătură intermediare între aceste niveluri nu sunt permise. Aceasta a fost o presupunere revoluționară.[6]
Franck și Hertz au sugerat că caracteristica de 4,9 V a experimentelor lor se datorează ionizării atomilor de mercur prin coliziuni cu electronii emiși de catod. În 1915, Bohr a publicat o lucrare în care a arătat că măsurătorile lui Franck și Hertz erau mai consistente cu ipoteza nivelurilor cuantice din model său al atomului.[18] În modelul Bohr, ciocnirea excita un electron din interiorul atomului de la cel mai mic nivel până la primul nivel cuantic de deasupra lui. Modelul Bohr prezicea, de asemenea, că s-ar emite lumină pe măsură ce electronul intern se întoarce de la nivelul său cuantic excitat la cel mai scăzut; lungimea de undă a acestei lumini corespunde cu diferența de energie între nivelurile interne ale atomului, corespondență numită relația Bohr.[4] Observațiile lui Franck și Hertz despre emisia de 254 nm din tubul lor era și ea în conformitate cu perspectiva lui Bohr. Scriind după încheierea Primului Război Mondial în 1918, Franck și Hertz au adoptat în mare măsură perspectiva lui Bohr pentru interpretarea experimentului lor, care a devenit unul dintre pilonii experimentali ai mecanicii cuantice.[1][3] Așa cum se exprima Abraham Pais, „acum, frumusețea lucrării lui Franck și Hertz constă nu numai în măsurarea pierderii de energie E2-E1 a electronului care se ciocnește, ei au observat și că atunci când energia acestui electron depășește 4,9 eV, mercurul începe să emită lumină ultravioletă cu o frecvență definită ν definită în formula de mai sus. Astfel, ei au dat (la început, fără să știe) prima dovadă experimentală directă a relației Bohr!”[4] Franck însuși a subliniat importanța experimentului cu emisii ultraviolete într-un epilog pentru filmul din 1960 al Comisiei pentru Studiul Științelor Fizice(d) (PSSC) despre experimentul Franck-Hertz.[16]
Experimentul cu neon
[modificare | modificare sursă]
În laboratoarele universitare, experimentul Franck-Hertz este adesea realizat folosind neon, gaz care prezintă debutul coliziunilor inelastice cu o strălucire vizibilă portocalie în tubul vidat și care este și netoxic, în cazul în care se sparge tubul. La tuburile cu mercur, modelul pentru coliziuni elastice și inelastice prezice că ar trebui să existe benzi înguste între anod și grilă, unde mercurul emite lumină, dar lumina este ultravioletă și invizibilă. La neon, intervalul de tensiune Franck-Hertz este de 18,7 volți și apare o luminozitate portocalie vizibilă lângă grilă atunci când se aplică această tensiune. Această strălucire se va apropia mai mult de catod, cu creșterea potențialului de accelerare, și indică locațiile în care electronii ajung la cei 18,7 eV necesari pentru excitarea unui atom de neon. La 37,4 volți vor fi vizibile două străluciri distincte: unul la jumătatea distanței dintre catod și grilă și unul chiar la grila de accelerare. Potențialele mai mari, distanțate la intervale de 18,7 volți, vor avea ca rezultat regiuni suplimentare strălucitoare în tub.
Un avantaj suplimentar al neonului pentru laboratoarele universitare este acela că tubul poate fi utilizat la temperatura camerei. Cu toate acestea, lungimea de undă a emisiei vizibile este mult mai lungă decât cea prevăzută de relația Bohr și de intervalul de 18,7 V. O explicație parțială pentru lumina portocalie implică două niveluri atomice situate la 16,6 eV și 18,7 eV deasupra celui mai scăzut nivel. Electronii excitați la nivelul de 18,7 eV scad până la nivelul de 16,6 eV, cu o emisie de lumină portocalie concomitentă. [19]
Note
[modificare | modificare sursă]- ^ a b c Rice, Stuart A.; Jortner, Joshua (). „James Franck 1882-1964: A Biographical Memoir” (PDF). Academia Națională de Științe a Statelor Unite ale Americii(d) (US). p. 6.
Our understanding of the world was transformed by the results of this experiment; it is arguably one of the most important foundations of the experimental verification of the quantum nature of matter.
- ^ a b c d e Franck, J.; Hertz, G. (). „Über Zusammenstöße zwischen Elektronen und Molekülen des Quecksilberdampfes und die Ionisierungsspannung desselben” [Despre coliziunile între electroni și moleculele de vapori de mercur și potențialul de ionizare al acestora] (PDF). Verhandlungen der Deutschen Physikalischen Gesellschaft (în German). 16: 457–467. Arhivat din original (PDF) la . Accesat în . O traducere a lucrării în engleză apare în Boorse, Henry A.; Motz, Lloyd (). „46. The Quantum Theory is Tested”. The World of the Atom (în engleză). 1. Basic Books. pp. 766–778. OCLC 534667. În lucrările inițiale, Franck și Hertz interpretaseră potențialul de 4,9 V asociat coliziunilor inelastice electron-mercur ca indicând potențialul de ionizare al mercurului. Relația cu modelul Bohr al atomului a apărut mai târziu.
- ^ a b c Lemmerich, Jost (). Science and Conscience: The Life of James Franck (în engleză). Translated by Ann Hentschel. Stanford University Press. pp. 45–50. ISBN 9780804779098.
Then two papers by Franck and Hertz about measurements on vaporized mercury that were to enter their names on the rolls of the history of physics appeared in quick succession. The first paper was presented by Gustav Hertz at the German Physical Society's meeting on 24 April 1914, the second by James Franck on May 22. (p. 45)
Traducere după Aufrecht im Sturm der Zeit : der Physiker James Franck, 1882-1964 (în germană). Verlag für Geschichte der Naturwissenschaften und der Technik. . ISBN 9783928186834. OCLC 234125038. - ^ a b c d e Pais, Abraham (). „Introducing Atoms and Their Nuclei”. În Brown, Laurie M.; Pais, Abraham; Pippard, Brian. Twentieth Century Physics (în engleză). 1. American Institute of Physics Press. p. 89. ISBN 9780750303101.
Now the beauty of Franck and Hertz's work lies not only in the measurement of the energy loss E2-E1 of the impinging electron, but they also observed that, when the energy of that electron exceeds 4.9 eV, mercury begins to emit ultraviolet light of a definite frequency ν as defined in the above formula. Thereby they gave (unwittingly at first) the first direct experimental proof of the Bohr relation!
Frecvența ν este în relație cu lungimea de undă λ a luminii prin formula ν = c/λ, unde c=2.99×108 metri pe secundă este viteza luminii în vid. - ^ a b Pentru convertirea electron-volților la viteze ale electronilor, vezi „The speed of electrons”. Practical Physics (în engleză). Nuffield Foundation(d). Arhivat din original la . Accesat în .
- ^ a b Cohen, I. Bernard (). Revolution in Science (în engleză). Belknap Press. pp. 427–428. ISBN 9780674767775.
In 1912 a young Dane working in Rutherford's laboratory in Manchester proposed a revolutionary new model of the atom. ... What made Bohr's theory difficult to believe in was the idea of discrete and fixed states or orbits, with no intermediate states being possible.
- ^ a b c Franck, J.; Hertz, G. (). „Über die Erregung der Quecksilberresonanzlinie 253,6 μμ durch Elektronenstöße” [Despre excitația liniilor de rezonanță ale mercurului la 253.6 μμ prin coliziuni cu electroni]. Verhandlungen der Deutschen Physikalischen Gesellschaft (în German). 16: 512–517. Simbolul μμ este o utilizare rară și depășită pentru nanometru. Acest articol a fost retipărit în Franck, James; Hertz, Gustav; Hermann, Armin (). Die Elektronenstoßversuche (în germană). München: E. Battenberg. OCLC 9956175.
- ^ Oseen, C. W. (). „Nobel Prize in Physics 1925 - Presentation Speech”. The Nobel Foundation.
- ^ Huber, Marcia L.; Laesecke, Arno; Friend, Daniel G. (aprilie 2006). „The vapor pressure of mercury” (PDF). National Institute of Standards. p. 5. Arhivat din original (PDF) la . Accesat în .
- ^ a b Brandt, Siegmund (). „25. The Franck Hertz experiment (1914)”. The harvest of a century : discoveries of modern physics in 100 episodes (în engleză). Oxford University Press. p. 272. ISBN 9780191580123.
- ^ Thornton, Stephen; Rex, Andrew (). Modern Physics for Scientists and Engineers (în engleză) (ed. 4). Cengage Learning. pp. 154–156. ISBN 9781133103721.
- ^ Pais, Abraham (). Subtle is the Lord: The Science and the Life of Albert Einstein (în engleză). Oxford University Press. p. 381. ISBN 9780191524028. Energia E a unui foton este produsul dintre constanta lui Planck h și raportul c/λ între viteza luminii c și lungimea de undă λ.
- ^ a b c Melissinos, Adrian Constantin; Napolitano, Jim (). „1.3 The Franck–Hertz Experiment”. Experiments in Modern Physics (în engleză). Gulf Professional Publishing. pp. 10–19. ISBN 9780124898516. Această lucrare sugerează incorect că Franck și Hertz ar fi știut de modelul Bohr când și-au publicat experimentele. Franck însuși a făcut această remarcă într-un interviu acordat spre sfârșitul vieții; vezi Holton, Gerald (). „On the recent past of physics”. American Journal of Physics (în engleză). 61 (12): 808. Bibcode:1961AmJPh..29..805H. doi:10.1119/1.1937623.
- ^ a b c d Demtröder, Wolfgang (). „3.4.4 Franck–Hertz experiment”. Atoms, Molecules and Photons: An Introduction to Atomic-, Molecular- and Quantum Physics (în engleză). Springer. pp. 118–120. ISBN 9783642102981.
- ^ În experimentul inițial, Franck și Hertz au folosit platină atât pentru catod, cât și pentru grilă. Când se folosesc alte materiale pentru electrozi, există o contribuție suplimentară la energia cinetică în plus față de tensiunea aplicată din exterior. Vezi Thornton, Stephen; Rex, Andrew (). Modern Physics for Scientists and Engineers (în engleză) (ed. 4). Cengage Learning. pp. 154–156. ISBN 9781133103721.
- ^ a b În 1960, Franck a explicat că el și Hertz nu știau de ideile lui Bohr când și-au prezentat cele două lucrări din 1914. Franck a făcut remarcile drept epilog al filmului despre experimentul Franck–Hertz de la Comisia pentru Studiul Științelor Fizice(d) (1960). Filmul este disponibil online; vezi Byron L. Youtz (narrator); James Franck (epilogue); Jack Churchill (director) (1960) (în en). Franck-Hertz experiment. Educational Services. 25 minutes in. OCLC 4949442. https://archive.org/details/FranckHertzExperiment. Accesat la 1 iulie 2014.. Stenograma epilogului a fost publicată la scurt timp după realizarea filmului; vezi Holton, Gerald (). „On the recent past of physics”. American Journal of Physics (în engleză). 61 (12): 808. Bibcode:1961AmJPh..29..805H. doi:10.1119/1.1937623.
- ^ Heilbron, John L. (). „Bohr's First Theories of the Atom”. În French, A. P.; Kennedy, P. J. Niels Bohr: A Centenary Volume (în engleză). Cambridge, Massachusetts: Harvard University Press. pp. 33–49. ISBN 9780674624160. OCLC 12051112.
- ^ Kragh, Helge (). Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure 1913-1925. Oxford University Press. p. 144. ISBN 9780191630460.
- ^ Csele, Mark (). „2.6 The Franck–Hertz Experiment”. Fundamentals of Light Sources and Lasers (în engleză). John Wiley & Sons. pp. 31–36. ISBN 9780471675228.
Lectură suplimentară
[modificare | modificare sursă]- Basile, Giorgio. „3B Scientific Mercury Franck–Hertz Tube U8482170” (în engleză). Selecție de imagini cu tuburi vidate utilizat pentru experimentul Franck-Hertz în laboratoarele universitare.
- Franck, James (). „Transformation of Kinetic Energy of Free Electrons into Excitation Energy of Atoms by Impacts”. Nobel Lectures, Physics 1922–1941 (PDF) (în engleză). Elsevier. Traducerea prelegerii Nobel a lui Franck, ținută la .
- Gearhart, Clayton A. (). „The Franck-Hertz Experiments, 1911–1914: Experimentalists in Search of a Theory”. Physics in Perspective (în engleză). 16 (3): 293–343. Bibcode:2014PhP....16..293G. doi:10.1007/s00016-014-0139-3.
- Hertz, Gustav (). „The results of the electron-impact tests in the light of Bohr's theory of atoms”. Nobel Lectures, Physics 1922–1941 (PDF) (în engleză). Elsevier. Traducerea prelegerii Nobel a lui Hertz, ținută la .
- Nicoletopoulos, Peter (). „Up-to-date literature on the Franck–Hertz Experiment”. Arhivat din original la . Vezi și „Up-to-date literature on the Franck–Hertz experiment”. Arhivat din original la . Accesat în . Nicoletopoulos, care a murit în 2013, a fost autor și coautor al mai multor lucrări legate de experimentul Franck-Hertz; aceste lucrări contestă interpretările convenționale ale experimentului. Vezi Robson, Robert; White, Ronald. „In Memory of Peter Nicoletopoulos”. ARC Centre of Excellence for Antimatter–Matter Studies: Annual Report 2012 (PDF) (în engleză). Australian Research Council. p. 3. Arhivat din original (PDF) la . Accesat în .
- Rapior, G.; Sengstock, K.; Baev, V. (). „New features of the Franck–Hertz experiment” (PDF). Am. J. Phys. (în engleză). 74 (5): 423–428. Bibcode:2006AmJPh..74..423R. doi:10.1119/1.2174033. Arhivat din original (PDF) la . Accesat în . În lucrarea inițială a lui Franck și Hertz, au fost consemnați curenți anodici de până la aproximativ 15 V, așa cum se arată în figura de mai sus. Maximele și minimele adiționale apar atunci când curentul este măsurat la tensiuni mai mari. Această lucrare consemnează că distanța dintre minime și maxime nu este exact de 4,9 V, ci crește pentru tensiuni mai mari și variază în funcție de temperatură, oferind un model și pentru acest efect.
