Nucleație
| Termodinamică | ||||||||
|---|---|---|---|---|---|---|---|---|
 Schema unei mașini termice Carnot | ||||||||
|
||||||||
Nucleația este primul pas în formarea, fie a unei noi faze termodinamice, fie a unei noi structuri prin autoasamblare sau autoorganizare. Nucleația este de obicei definită ca fiind procesul care determină timpul cât trebuie să aștepte un observator înainte ca o nouă fază sau o nouă structură autoorganizată să apară. Nucleația se dovedește a fi adesea foarte sensibilă la impuritățile din sistem. Din acest motiv, este de multe ori important să se facă distincția între nucleația eterogenă și nucleația omogenă. Nucleația eterogenă are loc în zonele de nucleație ale suprafețelor sistemului[1]. Nucleația omogenă are loc departe de orice suprafață.
Caracteristici
[modificare | modificare sursă]
Nucleația este de obicei un proces stohastic, astfel încât, chiar și în două sisteme identice, nucleația va avea loc la momente diferite.[2][3][4] Acest comportament este similar cu dezintegrarea radioactivă. Un mecanism comun este ilustrat în animație în figura alăturată. Acesta arată nucleația unei noi faze (în roșu) într-o faza existentă (alb). În faza existentă fluctuațiile microscopice ale fazei roșii apar și se degradează continuu, până când o neobișnuit de mare fluctuație a noii faze roșii este atât de mare, încât este mai favorabil pentru aceasta să crească decât să se întoarcă la nimic. Atunci acest nucleu al fazei roșii crește și trece sistemul în această fază. Teoria standard care descrie acest comportament în nucleația unei noi faze termodinamice este numită teoria clasică a nucleației.
Pentru formarea unei noi faze termodinamice, cum ar fi formarea de gheață în apă sub 0 °C, dacă sistemul nu este în pas cu timpul și nucleația se produce într-un singur pas, atunci probabilitatea ca nucleația să nu aibă loc ar trebui să sufere o dezintegrare exponențială după cum se vede în dezintegrarea radioactivă. Acest lucru se vede, de exemplu, în nucleația gheții în picăturile mici de apă suprarăcite.[5] Rata dezintegrării exponențiale dă rata nucleației . Teoria clasică a nucleației este o teorie utilizată pe scară largă pentru estimarea acestor rate, și modul în care variază în funcție de variabile precum temperatura. Ea face o predicție corectă când spune că timpul de așteptare pentru formarea de nuclee scade extrem de rapid atunci când este suprasaturată.[2][3]
Aceasta nu este doar noua etape, cum ar fi lichide si cristale, care formează prin nucleație urmată de o creștere. Procesul de auto-asamblare care formează obiecte, cum ar fi agregate amiloide asociate cu boala Alzheimer , de asemenea, începe cu formarea de nuclee.[6] Consumatoare de energie, sistemele care se autoorganizează, cum ar fi microtubulii în celule, manifestă, de asemenea, nucleație și creștere.
Exemple
[modificare | modificare sursă]- Norii se formează când aerul umed se răcește (de multe ori pentru că se ridică) și multe picături mici de apă se nuclează din cauza aerului suprasaturat.[7] Cantitatea de vapori de apă pe care aerul o poate transporta scade odată cu scăderea temperaturii. Excesul de vapori începe să se nucleeze și formează picături mici de apă care formează un nor. Formarea picăturilor fine de apă lichidă este eterogenă, care apar pe particule denumite nuclee de nor de condensare. Însămânțarea norilor este procesul de adăugare de nuclee artificiale de condensare pentru a accelera formarea norilor.
- Nucleația este primul pas în cristalizare, astfel încât aceasta determină faptul dacă un cristal se poate forma sau nu. Frecvent, unele cristale nu se formează nici când acestea sunt termodinamic favorizate. De exemplu, picături mici de apă foarte pură pot rămâne lichide până sub -30°C, deși gheața este starea stabilă sub 0°C[8].
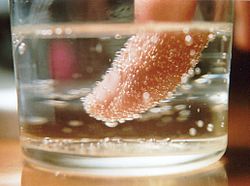
- Bulele de dioxid de carbon se nuclează la scurt timp după ce presiunea este eliberată dintr-un recipient de lichid carbonatat. Nucleația de multe ori apare mai ușor la o interfață preexistentă (nucleație eterogenă), așa cum se întâmplă la când facem cartofi prăjiți și șir de caractere utilizat pentru a face bomboane de rock.
- Nucleația în timpul fierberii poate avea loc în cea mai mare parte a lichidului în cazul în care presiunea este redusă, astfel încât lichidul devine supraîncălzit în funcție de presiunea dependentă de punctul de fierbere. De cele mai multe ori, nucleația apare pe suprafața de încălzire, în zonele de nucleație. De obicei, zonele de nucleație sunt fisuri fine în care suprafața gaz liber-lichid este menținută sau pete pe suprafața de încălzire cu proprietăți de umezire mai slabe. Substanțiala supraîncălzire a unui lichid poate fi realizată după ce lichidul este de-gazat și dacă suprafețele sunt curate, netede și a făcute din materiale bine udate de lichid.
- Unele agitatoare de șampanie operează prin furnizarea de mai multe nuclee de coagulare prin intermediul unei suprafețe mari și cu colțuri ascuțite, pentru a accelera eliberarea de bule și eliminarea carbonatării din vin.
- Nucleația microtubul este nucleația de microtubuli, lungi tije tubulare în celulele eucariote. Această nucleație nu este o fază termodinamică și, ca și alte aspecte ale dinamicii microtubulilor, este un proces de consumator de energie.
- Erupția bomboanei Mentos este un alt exemplu. Suprafața de bomboanei Mentos oferă zone de nucleație pentru formarea de bule de dioxid de carbon din sucurile carbogazoase.
Eterogenă
[modificare | modificare sursă]
Nucleația eterogenă, nucleația cu nucleul la o suprafață, este mult mai frecventă decât nucleația omogenă.[9][10] Nucleația eterogenă este de obicei considerată a fi mult mai rapidă decât nucleația omogenă folosind teoria clasică a nucleației. Aceasta face predicția că nucleația incetinește exponențial cu înălțimea unei bariere de energie liberă ΔG*. Această barieră vine din sancționarea formării suprafeței nucleului în creștere de către energia liberă. La nucleația omogenă, nucleul este aproximat printr-o sferă, dar după cum putem vedea în schema cu picături macroscopice la dreapta, picăturile de pe suprafețe nu sunt complete sferice și deci zona de interfață între picătură și fluidul înconjurător este mai mică decât este . Această reducere în suprafață a nucleului reduce înălțimea barierei de nucleație și deci mărește exponențial viteza de nucleație [11]
Nucleația poate începe, de asemenea, la suprafața unui lichid. De exemplu, simulări pe calculator ale nanoparticulelor de aur arată că faza de cristal nuclează la suprafața aurului lichid[12].
Studierea simulării pe calculator a unor modele simple
[modificare | modificare sursă]Teoria clasică a nucleației face o serie de ipoteze; de exemplu, se tratează un nucleu microscopic ca și cum ar fi o picătură macroscopică cu o suprafață bine definită a cărei energie liberă este estimată cu ajutorul unei proprietăți de echilibru: tensiunea interfacială σ. Pentru un nucleu care poate fi nu mai mare decât zece molecule la un loc, nu este întotdeauna clar că putem trata ceva atât de mic ca pe un volum plus o suprafață. De asemenea, nucleația este în mod inerent un fenomen în afara echilibrului termodinamic, astfel încât nu este întotdeauna evident că rata ei poate fi estimată folosind proprietatea echilibrului.
Cu toate acestea, calculatoarele moderne sunt suficient de puternice pentru a calcula, în esență, exact, rata nucleației pentru modele simple. Acestea au fost comparate cu teoria clasică, de exemplu, pentru cazul nucleației fazei cristal în cazul modelului sferelor grele. Acesta este un model de sfere perfect grele în mișcare termică, și este un model simplu a unor coloizi. Pentru cristalizarea sferelor grele teoria clasică este o teorie foarte rezonabil aproximată.[13] Deci, pentru studiul modelelor simple teoria clasică a nucleației funcționează destul de bine, dar nu știm dacă funcționează la fel de bine când e vorba de cristalizarea moleculelor complexe.
Regiunea spinodală
[modificare | modificare sursă]Procesele de tranziție de fază pot fi, de asemenea, explicate în termeni de descompunere spinodală, în care separarea fazelor este întârziată până când sistemul intră în zona instabilă în care o mică perturbare în compoziție duce la o scădere în energie și, astfel, la o spontană creștere a perturbațiilor[14]. Această regiune a diagramei de fază este cunoscută ca regiunea spinodală și procesul de separare a fazelor este cunoscut sub numele de descompunerea spinodală și pot fi determinate de ecuația Cahn–Hilliard.
Experimente pe nucleația cristalelor
[modificare | modificare sursă]De obicei este dificil de a studiat experimental nucleația. Nucleul este microscopic și, astfel, prea mic pentru a fi observat direct. În volume mari de lichide se petrec, de obicei, multiple nucleații și este dificil de diferențiat efectele de nucleație de cele de creștere a fazei nucleate. Aceste probleme pot fi depășite dacă se lucrează cu picături mici. Cum nucleația este stochastică, sunt necesare multe picături, astfel încât pot fi obținute statistici ale nucleațiilor.

La dreapta este prezentat un exemplu de set de date de nucleație. Este pentru nucleația la temperatură constantă și, prin urmare, suprasaturarea fazei cristal a unor picături fine de staniu lichid suprarăcit; aceasta este lucrarea lui Pound și La Mer[15].
Referințe
[modificare | modificare sursă]- ^ H. R. Pruppacher and J. D. Klett, Microphysics of Clouds and Precipitation, Kluwer (1997)
- ^ a b H. R. Pruppacher and J. D. Klett, Microphysics of Clouds and Precipitation, Kluwer (1997).
- ^ a b Sear, R.P. (). „Nucleation: theory and applications to protein solutions and colloidal suspensions” (PDF). J. Physics Cond. Matt. 19 (3): 033101. Bibcode:2007JPCM...19c3101S. doi:10.1088/0953-8984/19/3/033101. Arhivat din original (PDF) la . Accesat în . Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ Sear, Richard P. (). „Quantitative Studies of Crystal Nucleation at Constant Supersaturation: Experimental Data and Models”. CrystEngComm. 16 (29): 6506. doi:10.1039/C4CE00344F. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ Duft, D.; Leisner (). „Laboratory evidence for volume-dominated nucleation of ice in supercooled water microdroplets”. Atmospheric Chemistry and Physics. 4 (7): 1997. doi:10.5194/acp-4-1997-2004. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ Gillam, J.E.; MacPhee, C.E. (). „Modelling amyloid fibril formation kinetics: mechanisms of nucleation and growth”. J. Phys. Condens. Matter. 25 (37): 373101. doi:10.1088/0953-8984/25/37/373101. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ H. R. Pruppacher and J. D. Klett, Microphysics of Clouds and Precipitation, Kluwer (1997).
- ^ H. R. Pruppacher and J. D. Klett, Microphysics of Clouds and Precipitation, Kluwer (1997)
- ^ H. R. Pruppacher and J. D. Klett, Microphysics of Clouds and Precipitation, Kluwer (1997).
- ^ Sear, Richard P. (). „Quantitative Studies of Crystal Nucleation at Constant Supersaturation: Experimental Data and Models”. CrystEngComm. 16 (29): 6506. doi:10.1039/C4CE00344F. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ Sear, R.P. (). „Nucleation: theory and applications to protein solutions and colloidal suspensions” (PDF). J. Physics Cond. Matt. 19 (3): 033101. Bibcode:2007JPCM...19c3101S. doi:10.1088/0953-8984/19/3/033101. Arhivat din original (PDF) la . Accesat în . Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ Mendez-Villuendas, Eduardo; Bowles, Richard (). „Surface Nucleation in the Freezing of Gold Nanoparticles”. Physical Review Letters. 98 (18): 185503. Bibcode:2007PhRvL..98r5503M. doi:10.1103/PhysRevLett.98.185503. PMID 17501584. Mai multe valori specificate pentru
|pmid=și|PMID=(ajutor); Mai multe valori specificate pentru|DOI=și|doi=(ajutor) - ^ Auer, S.; D. Frenkel (). „Numerical prediction of absolute crystallization rates in hard-sphere colloids”. J. Chem. Phys. 120 (6): 3015. Bibcode:2004JChPh.120.3015A. doi:10.1063/1.1638740. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor) - ^ Mendez-Villuendas, Eduardo; Saika-Voivod, Ivan; Bowles, Richard K. (). „A limit of stability in supercooled liquid clusters”. The Journal of Chemical Physics. 127 (15): 154703. Bibcode:2007JChPh.127o4703M. doi:10.1063/1.2779875. PMID 17949187. Mai multe valori specificate pentru
|pmid=și|PMID=(ajutor); Mai multe valori specificate pentru|DOI=și|doi=(ajutor) - ^ Pound, Guy M.; V. K. La Mer (). „Kinetics of Crystalline Nucleus Formation in Supercooled Liquid Tin”. J. American Chemical Society. 74 (9): 2323. doi:10.1021/ja01129a044. Mai multe valori specificate pentru
|DOI=și|doi=(ajutor)
















