Transpoziție Lossen
Transpoziția Lossen este o reacție organică prin care are loc transformarea acizilor hidroxamici (1) la izocianați (3) prin intermediul unor unor O-derivați de tip O-acil, O-sulfonil sau O-fosforil ai acizilor hidroxamici (2). De exemplu, clorura de 4-toluensulfonil este utilizată pentru a forma un derivat de tip O-sulfonil al acidului hidroxamic.[1][2][3]
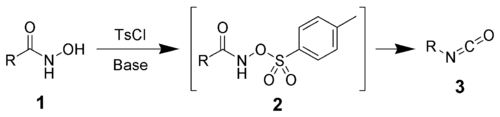
Izocianatul care a fost obținut în urma reacției de transpoziție poate fi utilizat pentru obținerea derivaților de uree, prin reacția cu aminele (4), sau pentru obținerea aminelor, prin reacția de hidroliză (5).

Acizii hidroxamici doriți se pot sintetiza plecând de la esterii corespunzători.[4] Au fost publicate câteva recenzii ale reacției.[5][6][7]
Mecanism de reacție
[modificare | modificare sursă]Mecanismul transpoziției Lossen debutează cu formarea derivatului O-acilat al acidului hidroxamic care va fi tratat cu o bază pentru a forma izocianatul. Derivatul acidului hidroxamic este prima dată convertit la baza sa conjugată printr-o etapă de deprotonare, care se realizează în mediul bazic. Etapa propriu-zisă de transpoziție are loc spontan, concomitent cu eliminarea unui anion carboxilat, obținându-se izocianatul. În mediu apos, datorită reacției de hidroliză cu H2O, izocianatul generează o amină și dioxid de carbon gazos, CO2 (decarboxilare).

Note
[modificare | modificare sursă]- ^ Lossen, W. (). „Ueber Benzoylderivate des Hydroxylamins”. Justus Liebigs Annalen der Chemie. 161 (2–3): 347–362. doi:10.1002/jlac.18721610219.
- ^ Lossen, W. (). „Ueber die Structurformel des Hydroxylamins und seiner amidartigen Derivate”. Justus Liebigs Annalen der Chemie. 175 (3): 271–304. doi:10.1002/jlac.18751750303.
- ^ Lossen, W. (). „Methode, die Carboxylgruppe aromatischer Säuren durch die Amidgruppe zu ersetzen”. Justus Liebigs Annalen der Chemie. 175 (3): 313–325. doi:10.1002/jlac.18751750305.
- ^ Hauser, C. R.; Renfrow, Jr.., W. B. (). „Benzohydroxamic Acid”. Organic Syntheses. 19: 15. doi:10.15227/orgsyn.019.0015.
- ^ Yale, H. L. (). „The Hydroxamic Acids”. Chem. Rev. 33 (3): 209–256. doi:10.1021/cr60106a002.
- ^ Bauer, L.; Exner, O. (). „The Chemistry of Hydroxamic Acids andN-Hydroxyimides”. Angew. Chem. Int. Ed. Engl. 13 (6): 376. doi:10.1002/anie.197403761.
- ^ Shioiri, Takayuki (). „Degradation Reactions”. Comprehensive Organic Synthesis. 6: 795–828. doi:10.1016/B978-0-08-052349-1.00172-4. ISBN 9780080359298.
