Piridină
| Piridină | |
 | |
 | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Azabenzol; Azină |
| Identificare | |
| Număr CAS | 110-86-1 |
| ChEMBL | CHEMBL266158 |
| PubChem CID | 1049 |
| Informații generale | |
| Formulă chimică | C5H5N |
| Aspect | incolor, cu miros neplăcut |
| Masă molară | 79,042 u.a.m.[1] |
| Proprietăți | |
| Densitate | 0,982 g/cm3 |
| Starea de agregare | lichidă |
| Punct de topire | -42 °C |
| Punct de fierbere | 115 °C |
| Solubilitate | bună în apă, etanol, eter, acetonă, uleiuri |
| Presiune de vapori | 16 mm Hg[2] |
| Viscozitate | dinamică 0,94 poiseuille |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Piridina (denumire IUPAC sistematică: azabenzen; denumită și azină) este un compus heterociclic ce conține un nucleu format din șase atomi, dintre care unul este de azot, având formula chimică C5H5N. Denumirea de azabenzen provine de la faptul că poate fi considerat ca un analog de benzen în care a fost înlocuită o grupare C-H cu un atom de azot.
Este un compus lichid, incolor. Face parte din structura multor compuși chimici importanți, precum produse farmaceutice, vitamine (niacină), etc. În trecut era obținută din gudronul de cărbune, iar în prezent se sintetizează la nivel industrial aproximativ 20.000 de tone într-un an.[3]
Istoric
[modificare | modificare sursă]Structura chimică a piridinei a fost determinată la zeci de ani după descoperirea sa. Wilhelm Körner (1869)[4] și James Dewar (1871)[5][6] au sugerat că, în analogie cu chinolina și naftalina, structura piridinei este derivată din benzen prin înlocuirea unei unități C-H cu un atom de azot.[7][8] Sugestia lui Körner și Dewar a fost confirmată ulterior într-un experiment în care piridina a fost redusă la piperidină cu sodiu în etanol.[9][10] În 1876, William Ramsay a combinat acetilena și acidul cianhidric în piridină într-un cuptor cu tuburi de fier.[11] Aceasta a fost prima sinteză a unui compus heteroaromatic.[12][13]
Prima sinteză majoră a derivaților piridinici a fost descrisă în 1881 de către Arthur Rudolf Hantzsch.[14] Sinteza piridinei a lui Hantzsch utilizează în mod obișnuit un amestec 2:1:1 de un β-cetoacid (adesea acetoacetat), o aldehidă (adesea formaldehidă) și amoniac sau sarea acestuia ca donor de azot. În primul rând, se obține o piridină dublu hidrogenată, care este apoi oxidată la derivatul piridinic corespunzător. Emil Knoevenagel a arătat că prin acest procedeu se pot obține derivați ai piridinei substituiți asimetric.[15]

Nomenclatură
[modificare | modificare sursă]Obținere
[modificare | modificare sursă]- Dealchilarea și decarboxilarea piridinelor substituite (picoline, etc.)
- Ciclizarea Bönnemann
- Sinteza Kröhnke
- Transpoziția Ciamician–Dennstedt
- Sinteza Gattermann–Skita
Proprietăți
[modificare | modificare sursă]Legături chimice
[modificare | modificare sursă]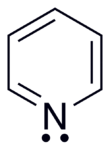
Piridina prezintă un sistem conjugat format din șase electroni π care sunt delocalizați pe nucleul hetero-aromatic. Molecula este plană și, astfel, urmează regulile Hückel pentru sistemele aromatice. Spre deosebire de benzen, densitatea electronică nu este distribuită uniform în nucleu, reflectând efectul inductiv negativ al atomului de azot. Din acest motiv, piridina are un moment dipolar și o stabilizare rezonantă mai slabă decât benzenul (energia de rezonanță 117 kJ/mol în piridină față de 150 kJ/mol în benzen).[16] Structurile de rezonanță se reprezintă astfel:

Atomii din ciclul piridinei sunt hibridizați sp2. Azotul este implicat în sistemul aromatic prin legături π utilizând orbitalul său p nehibridizat. Perechea de electroni neparticipanți se află într-un orbital sp2, care se proiectează spre exteriorul nucleului, în același plan cu legăturile σ. Ca urmare, perechea de electroni nu contribuie la sistemul aromatic, dar influențează major proprietățile chimice ale piridinei, deoarece induce cu ușurință formarea legăturilor prin intermediul unui atac electrofil.[17] Cu toate acestea, din cauza separării perechii de electroni neparticipanți de sistemul aromatic, atomul de azot nu poate prezenta un efect mezomeric pozitiv.


Sunt cunoscuți numeroși analogi ai piridinei în care atomul de azot este înlocuit cu alți heteroatomi din aceeași grupă a tabelului periodic. Substituirea unui C-H din piridină cu un al doilea N dă naștere heterociclurilor denumite la modul general diazină (C4H4N2), cu izomerii piridazină, pirimidină și pirazină.

Reacții chimice
[modificare | modificare sursă]Piridina permite ușor introducerea grupei amino la nucleul aromatic prin încălzire cu amidură de sodiu la 1100C, rezultând aminopiridinele: 2-aminopiridină și în cantități mici 4-aminopiridină și 2,6-diaminopiridină. 2,6-Diaminopiridina devine produsul principal al reacției la 1700C și cu un ușor exces de amidură[18].
Utilizări
[modificare | modificare sursă]Piridina este utilizată ca și bază (alcal) în diferite sinteze de medicamente și pesticide din chimia organică sau ca solvent și la denaturarea etanolului.
Siguranță
[modificare | modificare sursă]Note
[modificare | modificare sursă]- ^ a b „piridină”, PYRIDINE (în engleză), PubChem, accesat în
- ^ http://www.cdc.gov/niosh/npg/npgd0541.html Lipsește sau este vid:
|title=(ajutor) - ^ Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. (), „Pyridine and Pyridine Derivatives”, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_399
- ^ Koerner, W. (). „Synthèse d'une base isomère à la toluidine” [Synthesis of a base [that is] isomeric to toluidine]. Giornale di Scienze Naturali ed Economiche (Journal of Natural Science and Economics (Palermo, Italy)) (în franceză). 5: 111–114.
- ^ Dewar, James (). „On the oxidation products of picoline”. Chemical News. 23: 38–41. Arhivat din original la . Accesat în .
- ^ Rocke, Alan J. (). „Koerner, Dewar and the Structure of Pyridine”. Bulletin for the History of Chemistry. 2: 4. Arhivat din original la . Accesat în .

- ^ Ladenburg, Albert (). Lectures on the history of the development of chemistry since the time of Lavoisier (PDF). pp. 283–287. Arhivat din original (PDF) la . Accesat în .

- ^ Bansal, Raj K. (). Heterocyclic Chemistry. New Age International. p. 216. ISBN 81-224-1212-2.
- ^ Ladenburg, A. (). „Synthese des Piperidins” [Synthesis of piperidine]. Berichte der Deutschen Chemischen Gesellschaft (în germană). 17: 156. doi:10.1002/cber.18840170143. Arhivat din original la . Accesat în .
- ^ Ladenburg, A. (). „Synthese des Piperidins und seiner Homologen” [Synthesis of piperidine and its homologues]. Berichte der Deutschen Chemischen Gesellschaft (în germană). 17: 388–391. doi:10.1002/cber.188401701110. Arhivat din original la . Accesat în .
- ^ Ramsay, William (). „On picoline and its derivatives”. Philosophical Magazine. 5th series. 2 (11): 269–281. doi:10.1080/14786447608639105. Arhivat din original la . Accesat în .
- ^ Eroare la citare: Etichetă
<ref>invalidă; niciun text nu a fost furnizat pentru referințele numiteosha - ^ „A. Henninger, aus Paris. 12. April 1877”. Berichte der Deutschen Chemischen Gesellschaft (Correspondence). 10: 727–737. . doi:10.1002/cber.187701001202.
- ^ Hantzsch, A. (). „Condensationsprodukte aus Aldehydammoniak und ketonartigen Verbindungen” [Condensation products from aldehyde ammonia and ketone-type compounds]. Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 1637–1638. doi:10.1002/cber.18810140214. Arhivat din original la . Accesat în .
- ^ Knoevenagel, E.; Fries, A. (). „Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese” [Syntheses in the pyridine series. On an extension of the Hantzsch dihydropyridine synthesis]. Berichte der Deutschen Chemischen Gesellschaft. 31: 761–767. doi:10.1002/cber.189803101157. Arhivat din original la . Accesat în .
- ^ Joule, p. 7
- ^ Sundberg, Francis A. Carey; Richard J. (). Advanced Organic Chemistry : Part A: Structure and Mechanisms (ed. 5.). Berlin: Springer US. p. 794. ISBN 978-0-387-68346-1.
- ^ Nenitescu, p.686-687
Bibliografie
[modificare | modificare sursă]- Costin D. Nenițescu, Chimie Organică, vol. II, ediția a VIII-a, Editura Didactică și Pedagogică, 1980
Vezi și
[modificare | modificare sursă]- Pirazină
- Piridazină
- Piperidină
- Chinolină (benzo[b]piridină)
- Izochinolină (benzo[c]piridină)







